Hur man namnger kemiska föreningar
Författare:
Laura McKinney
Skapelsedatum:
2 April 2021
Uppdatera Datum:
26 Juni 2024

Innehåll
- stadier
- Metod 1 Nomenklatur för joniska föreningar
- Metod 2 Nomenklatur av polyatomiska föreningar
- Metod 3 Nomenklatur av kovalenta föreningar
För att lyckas inom området kemi krävs att man vet hur man anger de grundläggande kemiska föreningarna. Den här guiden ger dig grundläggande regler för namngivningsprocessen för kemiska föreningar och hur du tilldelar namn till föreningar som är okända för dig.
stadier
Metod 1 Nomenklatur för joniska föreningar
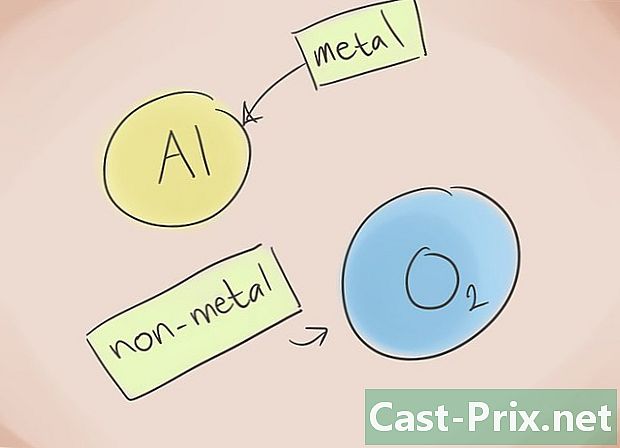
- Vad är en jonisk förening? Joniska föreningar består av en metall och en icke-metall. Hänvis sedan till den periodiska elementtabellen för att veta vilka kategorier som tillhör elementen som finns i föreningen.
-

Forma namnet. Ingenting är lättare än att namnge en jonisk förening av två element. I själva verket motsvarar den första delen av namnet på föreningen namnet på det icke-metalliska elementet som bär suffixet "ure" medan den andra motsvarar namnet på metallelementet. Det finns undantag: oxid, fosfid, nitrid, sulfid.- Exempel: Al2O3. al2 = Aluminium; O3 = Syre. Så namnet på föreningen kommer att vara "aluminiumoxid".
-
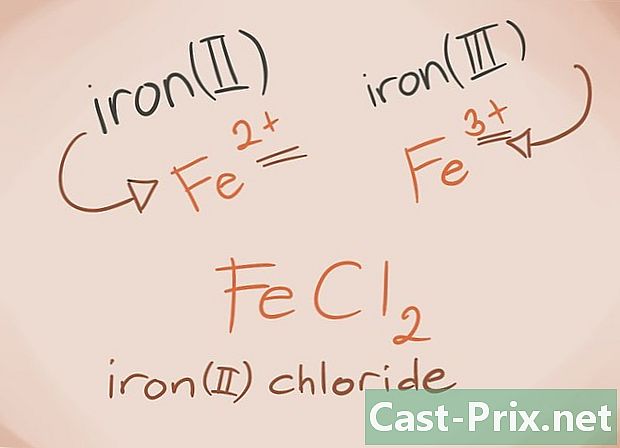
Känner till övergångsmetallerna. Övergångsmetallerna är de som finns i D- och F-blocken i det periodiska systemet. I föreningens namn skrivs laddningen på dessa metaller med romerska siffror. Detta beror på att övergångsmetaller kan bära mer belastning och bilda mer av en förening.- Exempel: FeCl2 och FeCl3. Fe = järn; cl2 = -2 klorid; cl3 = Klorid -3. Som namn kommer det att finnas järnklorid (II) och järnklorid (III).
Metod 2 Nomenklatur av polyatomiska föreningar
-

Du måste förstå vad en polyatomisk förening är. Polyatomiska föreningar är föreningar som bildas av en grupp datomer associerade med varandra; hela gruppen med en avgift är positiv eller negativ. Det finns sedan tre grundläggande åtgärder som du kan utföra på polyatomiska föreningar:- Du kan lägga till ett väte till den första delen av föreningen. Ordet "väte" läggs verkligen till i början av namnet på föreningen. Detta kommer att minska värdet på den negativa laddningen med en. Till exempel "karbonat" CO3 blir "vätekarbonat" -HCO3.

- Du kan också ta bort syre från föreningen. Lasten ändras inte, men "-ate" -suffixet av föreningen ändras till "-ique". Till exempel omvandlingen av: NO3 i NO2 vi går från nitrat till nitrat. "

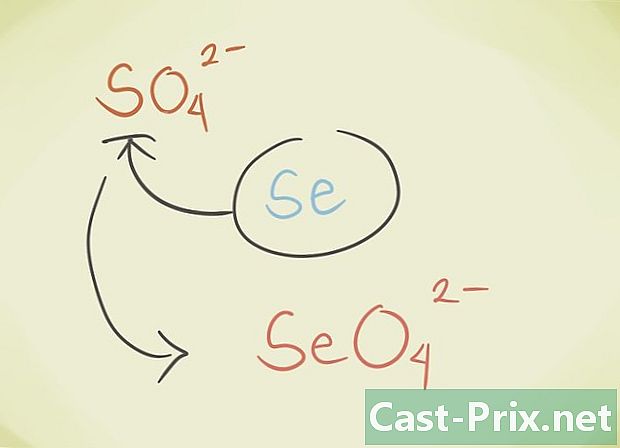
- Du kan ersätta föreningens centrala latome med en annan atom som tillhör samma periodiska grupp. Till exempel SO-sulfat4 kan ersättas av Selenate SeO4.
- Du kan lägga till ett väte till den första delen av föreningen. Ordet "väte" läggs verkligen till i början av namnet på föreningen. Detta kommer att minska värdet på den negativa laddningen med en. Till exempel "karbonat" CO3 blir "vätekarbonat" -HCO3.
-

Memorera de vanligaste diongrupperna. Grupperna nedan används för att bilda de flesta polyatomiska föreningar. Efter den ökande ordningen på deras negativa laddning har vi:- hydroxidjoner: OH
- nitratjoner: NO3
- Vätekarbonatjoner: HCO3
- permanganatjoner: MnO4
- karbonatjoner: CO3
- kromater: CrO4
- dikromatjoner: Cr2O7
- sulfatjoner: SO4
- sulfitjoner: SO3
- tiosulfatjoner: S2O3
- Fosfatjoner: PO4
- ammoniumjoner: NH4
- Forma sammansatta namn från listan ovan. Bilda en namnförening med något av de objekt som är relaterade till gruppen. Om elementet placeras före den joniska gruppen, kommer elementnamnet helt enkelt att läggas till i början av det sammansatta namnet.
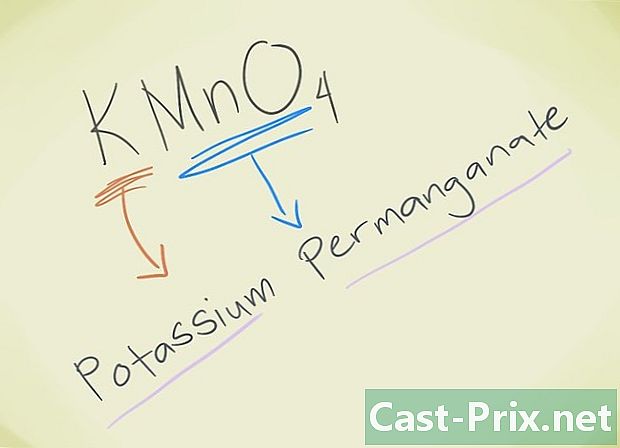
- Exempel: KMnO4. Du måste kunna veta den lejon MnO4 motsvarar lejonpermanganat. K avser kalium. Så din förening kommer att kallas Permanganat Kalium.
- Exempel: NaOH. Du kommer antagligen ha förstått här att det är OHOH. Na är natrium, så föreningen kommer att kallas natriumhydroxid.

- Exempel: KMnO4. Du måste kunna veta den lejon MnO4 motsvarar lejonpermanganat. K avser kalium. Så din förening kommer att kallas Permanganat Kalium.
Metod 3 Nomenklatur av kovalenta föreningar
-
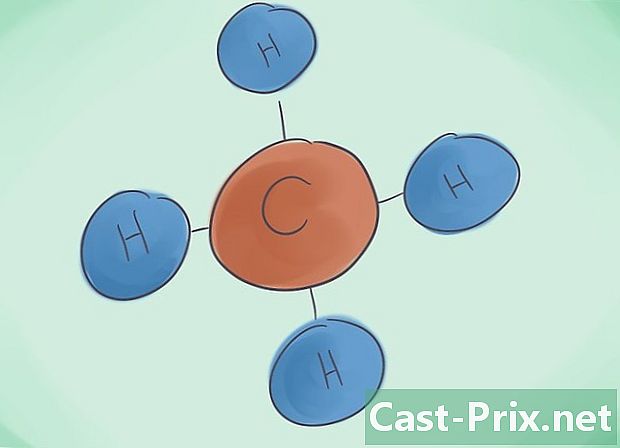
Vad är en kovalent förening? De kovalenta föreningarna är resultatet av föreningen av minst två icke-metalliska element. Föreningens namn bestäms av antalet datomer som utgör det. Det grekiska prefixet bredvid detta namn anger antalet molekyler som finns i föreningen. -
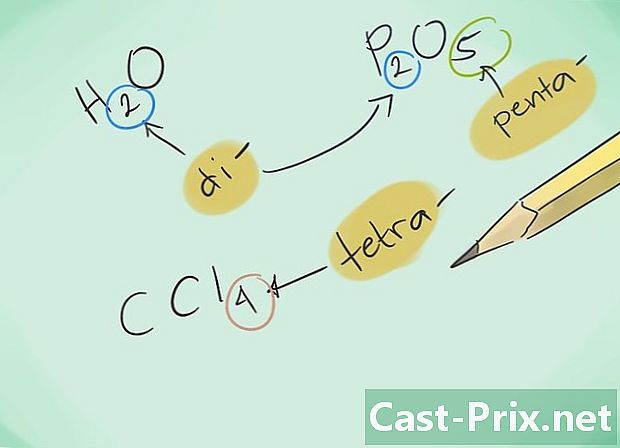
Bekanta dig med prefixen. Memorera följande prefix för föreningar med 1 till 8 atomer:- 1 atom - "Mono-"
- 2 atomer - "Di-"
- 3 atomer - "Tri-"
- 4 atomer - "Tetra-"
- 5 atomer - "Penta-"
- 6 atomer - "Hexa-"
- 7 atomer - "Hepta-"
- 8 atomer - "Octa-"
- Namnge sedan föreningarna. Namnge den resulterande föreningen med lämpliga prefix. Prefixerna ska ympas på vart och ett av elementen som utgör en förening med flera atomer.
- Exempel: CO kommer att återgå till kolmonoxid medan CO2 kommer att beteckna koldioxid.
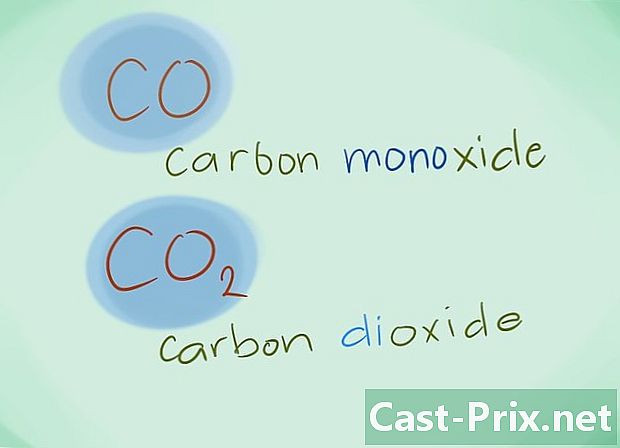
- Exempel: N2S3 skulle motsvara kvävgastrisulfid.

- I de flesta fall kan prefixet "mono" utelämnas; detta, mer än någon brist på prefix, inducerar att det senare bör användas. Detta prefix fortsätter att användas för kolmonoxid med tanke på det faktum att denna användning går tillbaka till de första glimmarna i kemi.
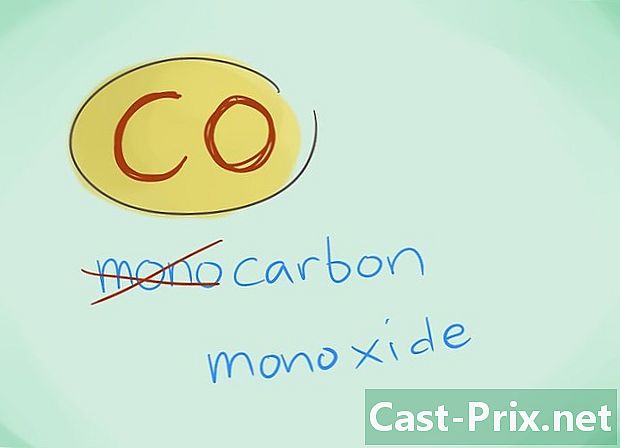
- Exempel: CO kommer att återgå till kolmonoxid medan CO2 kommer att beteckna koldioxid.
- Naturligtvis misstänker du att flera undantag gäller alla dessa regler; håll till exempel denna formel, CaCl2Du förväntar dig att se det kallad "kalciumdiklorid", vilket är NEJ. Din förening behåller helt enkelt namnet kalciumklorid.
- Det bör också noteras att allt detta inte gäller organisk kemi.
- De detaljerade reglerna här är avsedda för en nybörjare i kemi och vetenskap. Det finns mycket olika regler när du går igenom det avancerade kemifasen, som reglerna för variabel valens.

